Utilidad del índice de fibrosis hepática (IFH) medido durante la ultrasonografía endoscópica en la evaluación del parénquima pancreático
DOI:
https://doi.org/10.22516/25007440.644Palabras clave:
ultrasonografía endoscópica, elastografía, índice de fibrosis hepática, páncreas graso, esteatosis pancreática, cáncer de páncreasResumen
El ultrasonido endoscópico ha cambiado la evaluación de las enfermedades pancreáticas y ha logrado un diagnóstico histopatológico (cuando se asocia con la punción); sin embargo, este procedimiento requiere de entrenamiento, no está libre de complicaciones y alrededor de 25% de los pacientes puede tener falsos negativos. Por esto se ha implementado el uso de la elastografía cuantitativa con el strain ratio, el cual permite diferenciar las masas benignas de las malignas. Existe evidencia creciente, pero aún no conclusiva, dada la heterogeneidad de los resultados (sin consenso para su realización), por lo que es necesario desarrollar otros métodos, que permitan una mayor certeza diagnóstica, como el índice de fibrosis hepática (IFH) medido por ultrasonografía endoscópica, el cual tienen como base la inteligencia artificial, validado para el diagnóstico y el seguimiento de la fibrosis hepática. Nuestro grupo considera que se podría usar de la misma forma para valorar el parénquima pancreático.
Objetivo: evaluar si el IFH puede diferenciar tres tipos diferentes de tejidos pancreáticos: páncreas normal, páncreas graso y cáncer de páncreas.
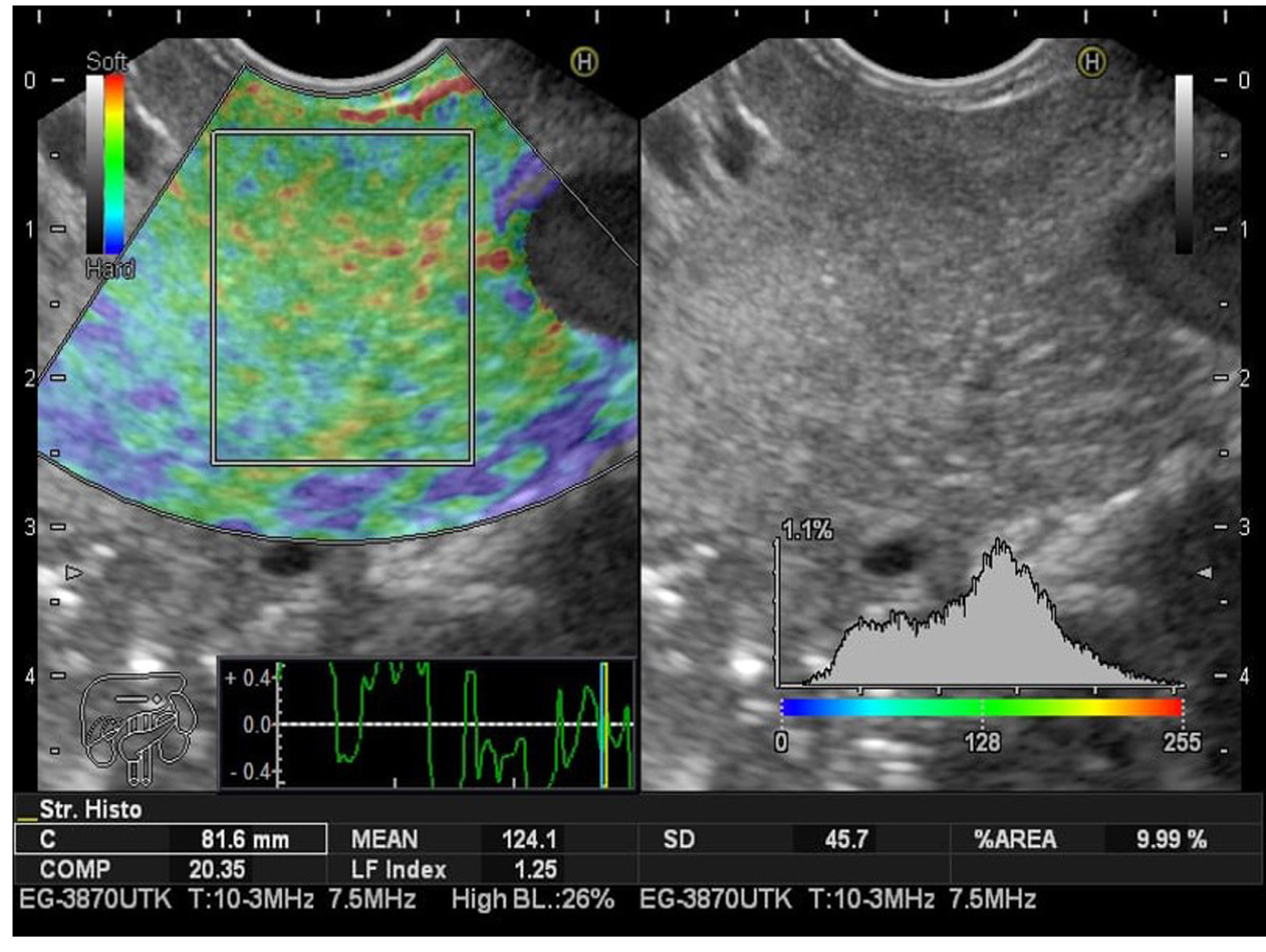
Metodología: estudio prospectivo de corte transversal en un solo centro. Se incluyeron 66 pacientes mayores de 18 años, con indicación de ultrasonografía endoscópica. El grupo 1 fue de pacientes con indicación diferente a la enfermedad biliopancreática (55 pacientes). En este grupo se aplicó la escala de clasificación de páncreas graso por ultrasonografía endoscópica (USE), utilizando como referencia la ecogenicidad del bazo (previamente validada); este grupo se subdividió en uno con parénquima pancreático normal y en otro con páncreas graso. En el grupo 2 (11 pacientes) se incluyeron los pacientes llevados para el estudio de lesión sólida pancreática, con diagnóstico citológico positivo para carcinoma de páncreas. Como herramienta de recolección de datos se utilizó un formulario virtual de Google Drive, disponible con dirección acortada: shorturl.at/pIMWX, diligenciado antes y después del procedimiento por fellows de Gastroenterología, previamente entrenados para este fin. El IFH se tomó en el páncreas en tiempo real mediante un software suministrado por el fabricante (Hitachi-Noblus), en un período comprendido entre enero de 2019 y enero 2020. A todos los pacientes se les realizó una ecoendoscopia biliopancreática completa, con un ecoendoscopio Pentax lineal y procesador Hitachi-Noblus; luego se efectuó una elastografía cualitativa y una cuantitativa, la cual incluyó la medición del IFH.
Resultados: en total se incluyeron 66 pacientes: 11 pacientes con diagnóstico confirmado por citología de cáncer de páncreas y 55 pacientes que se enviaron para ecoendoscopia por evaluación de otras patologías diferentes a la biliopancreática. El rango de edad fue de 23-89, media de 56,75 años. El antecedente más frecuente fue la esteatosis o esteatohepatitis (n = 14) (25,45 %). La indicación para la realización del procedimiento más frecuente fue la lesión subepitelial (n = 29) (52,73 %). Los porcentajes de pacientes según los grados de ecogenicidad del páncreas fueron de grado I (n = 29) (52,73 %); grado II (n = 5) (9,09 %); grado III (n = 18) (32,73 %); grado IV (n = 3) (5,45 %). Se tomaron los grados I y II como páncreas normal, y los grado III y IV como páncreas graso. Estos se dividieron en n = 34 pacientes (61,82 %) para páncreas normal y n = 21 (38 %) para páncreas graso; es decir, que de acuerdo con la escala utilizada hay una prevalencia para páncreas graso de 38,18 %. Se realizó el IFH en los tres subgrupos diferentes: los considerados como ecoendoscópicamente normales, los clasificados como páncreas graso y los pacientes con diagnóstico de cáncer de páncreas confirmado por citología, tomado en el páncreas. El IFH para los tres diferentes grupos fueron, respectivamente, normal: IFH 2,60, rango 0,97-3,47 (IC 95 % 2,17-3,02); páncreas graso: IFH 3,87, rango 2-5,5 (IC 95 % 3,44-4,29); cáncer de páncreas: IFH 6,35, rango 5,8-7,8 (IC 95 % 5,92-6,77).
Conclusiones: este es el primer estudio piloto que usa el IFH aplicado al parénquima pancreático, y se sugiere su utilidad para diferenciar, de manera no invasiva, el páncreas normal, el graso y el carcinoma de páncreas. Este hallazgo se debe confirmar en poblaciones más amplias y heterogéneas, con el fin de ser validado.
Descargas
Referencias bibliográficas
Gordon-Dseagu VL, Devesa SS, Goggins M, Stolzenberg-Solomon R. Pancreatic cancer incidence trends: Evidence from the surveillance, epidemiology and end results (SEER) population-based data. Int J Epidemiol. 2018;47(2):427-39. https://doi.org/10.1093/ije/dyx232
Petrov MS, Yadav D. Global epidemiology and holistic prevention of pancreatitis. Nat Rev Gastroenterol Hepatol. 2019;16(3):175-84. https://doi.org/10.1038/s41575-018-0087-5
Hisanaga K, Hisanaga A, Nagata K, Ichie Y. High speed rotating scanner for transgastric sonography. Am J Roentgenol. 1980;135(3):627-9. https://doi.org/10.2214/ajr.135.3.627
Dimagno EP, Regan PT, Clain JE, James EM, Buxton JL. Human endoscopic ultrasonography. Gastroenterology. 1982;83(4):824-9. https://doi.org/10.1016/S0016-5085(82)80012-7
Yamashita Y, Kato J, Ueda K, Nakamura Y, Kawaji Y, Abe H, et al. Contrast-enhanced endoscopic ultrasonography for pancreatic tumors. Biomed Res Int. 2015;2015:491782. https://doi.org/10.1155/2015/491782
Moutinho-Ribeiro P, Iglesias-García J, Gaspar R, Macedo G. Early pancreatic cancer - The role of endoscopic ultrasound with or without tissue acquisition in diagnosis and staging. Dig Liver Dis. 2019;51(1):4-9. https://doi.org/10.1016/j.dld.2018.09.027
DeWitt J, Devereaux BM, Lehman GA, Sherman S, Imperiale TF. Comparison of endoscopic ultrasound and computed tomography for the preoperative evaluation of pancreatic cancer: A systematic review. Clin Gastroenterol Hepatol. 2006;4(6):717-25. https://doi.org/10.1016/j.cgh.2006.02.020
DeWitt J, Devereaux B, Chriswell M, McGreevy K, Howard T, Imperiale TF, et al. Comparison of endoscopic ultrasonography and multidetector computed tomography for detecting and staging pancreatic cancer. Ann Intern Med. 2004;141(10):753-63. https://doi.org/10.7326/0003-4819-141-10-200411160-00006
Luz LP, Al-Haddad MA, Sey MSL, Dewitt JM. Applications of endoscopic ultrasound in pancreatic cancer. World J Gastroenterol. 2014;20(24):7808-18. https://doi.org/10.3748/wjg.v20.i24.7808
Wang W, Shpaner A, Krishna SG, Ross WA, Bhutani MS, Tamm EP, et al. Use of EUS-FNA in diagnosing pancreatic neoplasm without a definitive mass on CT. Gastrointest Endosc. 2013;78(1):73-80. https://doi.org/10.1016/j.gie.2013.01.040
Shi Y, Glaser KJ, Venkatesh SK, Ben-Abraham EI, Ehman RL. Feasibility of using 3D MR elastography to determine pancreatic stiffness in healthy volunteers. J Magn Reson Imaging. 2015;41(2):369-75. https://doi.org/10.1002/jmri.24572
Itoh A, Ueno E, Tohno E, Kamma H, Takahashi H, Shiina T, et al. Breast disease: Clinical application of US elastography for diagnosis. Radiology. 2006;239(2):341-50. https://doi.org/10.1148/radiol.2391041676.
Correas JM, Tissier AM, Khairoune A, Khoury G, Eiss D, Hélénon O. Ultrasound elastography of the prostate: State of the art. Diagn Interv Imaging. 2013;94(5):551-60. https://doi.org/10.1016/j.diii.2013.01.017
Lyshchik A, Higashi T, Asato R, Tanaka S, Ito J, Mai JJ, et al. Thyroid gland tumor diagnosis at US elastography. Radiology. 2005;237(1):202-11. https://doi.org/10.1148/radiol.2363041248
Dighe M, Luo S, Cuevas C, Kim Y. Efficacy of thyroid ultrasound elastography in differential diagnosis of small thyroid nodules. Eur J Radiol. 2013;82(6):e274-80. https://doi.org/10.1016/j.ejrad.2013.01.009
Schulman AR, Lin MV, Rutherford A, Chan WW, Ryou M. A prospective blinded study of endoscopic ultrasound elastography in liver disease: Towards a virtual biopsy. Clin Endosc. 2018;51(2):181-5. https://doi.org/10.5946/ce.2017.095
Pang JX, Zimmer S, Niu S, Crotty P, Tracey J, Pradhan F, et al. Liver stiffness by transient elastography predicts liver-related complications and mortality in patients with chronic liver disease. PLoS One. 2014;9(4):e95776.
https://doi.org/10.1371/journal.pone.0095776
Castéra L, Foucher J, Bernard PH, Carvalho F, Allaix D, Merrouche W, et al. Pitfalls of liver stiffness measurement: A 5-year prospective study of 13,369 examinations. Hepatology. 2010;51(3):828-35. https://doi.org/10.1002/hep.23425
Wong GLH, Wong VWS, Chim AML, Yiu KK, Chu SH, Li MK, et al. Factors associated with unreliable liver stiffness measurement and its failure with transient elastography in the Chinese population. J Gastroenterol Hepatol. 2011;26(2):300-5. https://doi.org/10.1111/j.1440-1746.2010.06510.x
Lucidarme D, Foucher J, Le Bail B, Vergniol J, Castera L, Duburque C, et al. Factors of accuracy of transient elastography (fibroscan) for the diagnosis of liver fibrosis in chronic hepatitis C. Hepatology. 2009;49(4):1083-9. https://doi.org/10.1002/hep.22748
Tatsumi C, Kudo M, Ueshima K, Kitai S, Ishikawa E, Yada N, et al. Non-invasive evaluation of hepatic fibrosis for type C chronic hepatitis. Intervirology. 2010;53(1):76-81. https://doi.org/10.1159/000252789
Fujimoto K, Kato M, Tonomura A, Yada N. Non-invasive evaluation method of the liver fibrosis using real-time tissue elastography. Usefulness of judgment liver fibrosis stage by liver fibrosis index (LF index). Kanzo. 2010;51(9):539-41. https://doi.org/10.2957/kanzo.51.539
Fujimoto K, Kato M, Kudo M, Yada N, Shiina T, Ueshima K, et al. Novel image analysis method using ultrasound elastography for noninvasive evaluation of hepatic fibrosis in patients with chronic hepatitis C. Oncology. 2013;84(1):3-12. https://doi.org/10.1159/000345883
Tatsumi C, Kudo M, Ueshima K, Kitai S, Takahashi S, Inoue T, et al. Noninvasive evaluation of hepatic fibrosis using serum fibrotic markers, transient elastography (FibroScan) and real-time tissue elastography. Intervirology. 2008;51(1):27-33. https://doi.org/10.1159/000122602
Benedict M, Zhang X. Non-alcoholic fatty liver disease: An expanded review. World J Hepatol. 2017;9(16):715-32. https://doi.org/10.4254/wjh.v9.i16.715
Sayiner M, Koenig A, Henry L, Younossi ZM. Epidemiology of nonalcoholic fatty liver disease and nonalcoholic steatohepatitis in the United States and the rest of the world. Clin Liver Dis. 2016;20(2):205-14. https://doi.org/10.1016/j.cld.2015.10.001
Kanwar P, Kowdley KV. The metabolic syndrome and its influence on nonalcoholic steatohepatitis. Clin Liver Dis. 2016;20(2):225-43. https://doi.org/10.1016/j.cld.2015.10.002.
Hirooka Y, Kuwahara T, Irisawa A, Itokawa F, Uchida H, Sasahira N, et al. JSUM ultrasound elastography practice guidelines: Pancreas. J Med Ultrason. 2015;42(2):151-74. https://doi.org/10.1007/s10396-014-0571-7
Giovannini M, Hookey L, Bories E, Pesenti C, Monges G, Delpero JR. Endoscopic ultrasound elastography: The first step towards virtual biopsy? Preliminary results in 49 patients. Endoscopy. 2006;38(4):344-8. https://doi.org/10.1055/s-2006-925158
Schaefer J. The normal weight of the pancreas in the adult human being: A biometric study. Anat Tec. 1926;32(2):119-32. https://doi.org/10.1002/ar.1090320204
Olsen TS. Lipomatosis of the pancreas in autopsy material and its relation to age and overweight. Acta Pathol Microbiol Scand A. 1978;86A(5):367-73. https://doi.org/10.1111/j.1699-0463.1978.tb02058.x
Ramkissoon R, Gardner TB. Pancreatic steatosis: An emerging clinical entity. Am J Gastroenterol. 2019;114(11):1726-34. https://doi.org/10.14309/ajg.0000000000000262
Prachayakul V, Aswakul P. Pancreatic steatosis: What should gastroenterologists know? J Pancreas. 2015;16(3):227-31. https://doi.org/10.6092/1590-8577/2987
Alempijevic T, Dragasevic S, Zec S, Popovic D, Milosavljevic T. Non-alcoholic fatty pancreas disease. Postgrad Med J. 2017;93(1098):226-30. https://doi.org/10.1136/postgradmedj-2016-134546
Sepe PS, Ohri A, Sanaka S, Berzin TM, Sekhon S, Bennett G, et al. A prospective evaluation of fatty pancreas by using EUS. Gastrointest Endosc. 2011;73(5):987-93. https://doi.org/10.1016/j.gie.2011.01.015
Othman MO, Wallace MB. The role of endoscopic ultrasonography in the diagnosis and management of pancreatic cancer. Gastroenterol Clin North Am. 2012;41(1):179-88. https://doi.org/10.1016/j.gtc.2011.12.014
Chen G, Liu S, Zhao Y, Dai M, Zhang T. Diagnostic accuracy of endoscopic ultrasound-guided fine-needle aspiration for pancreatic cancer: A meta-analysis. Pancreatology. 2013;13(3):298-304. https://doi.org/10.1016/j.pan.2013.01.013
Datos sobre la obesidad [Internet]. Organización Mundial de la Salud (consultado el 20 de enero de 2020). Disponible en: https://www.who.int/health-topics/obesity#tab=tab_1
Shah N, Rocha JP, Bhutiani N, Endashaw O. Nonalcoholic fatty pancreas disease. Nutr Clin Pract. 2019;34(Suppl 1):S49-S56. https://doi.org/10.1002/ncp.10397
Tariq H, Nayudu S, Akella S, Glandt M, Chilimuri S. Non-alcoholic fatty pancreatic disease: A review of literature. Gastroenterology Res. 2016;9(6):87-91. https://doi.org/10.14740/gr731w
Khoury T, Asombang AW, Berzin TM, Cohen J, Pleskow DK, Mizrahi M. The clinical implications of fatty pancreas: A concise review. Dig Dis Sci. 2017;62(10):2658-67. https://doi.org/10.1007/s10620-017-4700-1
Acharya C, Navina S, Singh VP. Role of pancreatic fat in the outcomes of pancreatitis. Pancreatology. 2014;14(5):403-8. https://doi.org/10.1016/j.pan.2014.06.004
Singh RG, Yoon HD, Wu LM, Lu J, Plank LD, Petrov MS. Ectopic fat accumulation in the pancreas and its clinical relevance: A systematic review, meta-analysis, and metaregression. Metabolism. 2017;69:1-13. https://doi.org/10.1016/j.metabol.2016.12.012
Mittal D, Kumar V, Saxena SC, Khandelwal N, Kalra N. Neural network based focal liver lesion diagnosis using ultrasound images. Comput Med Imaging Graph. 2011;35(4):315-23. https://doi.org/10.1016/j.compmedimag.2011.01.007.
Lightdale CJ. Endoscopic ultrasound. Gastrointest Endosc Clin N Am. 2005;15(1):863-79. https://doi.org/10.1016/j.giec.2004.08.001
Tamerisa R, Irisawa A, Bhutani MS. Endoscopic ultrasound in the diagnosis, staging, and management of gastrointestinal and adjacent malignancies. Med Clin North Am. 2005;89(1):139-58. https://doi.org/10.1016/j.mcna.2004.08.010
Luthra AK, Evans JA. Review of current and evolving clinical indications for endoscopic ultrasound. World J Gastrointest Endosc. 2016;8(3):157-64. https://doi.org/10.4253/wjge.v8.i3.157
Iglesias-García J, Lindkvist B, Lariño-Noia J, Domínguez-Muñoz JE. The role of EUS in relation to other imaging modalities in the differential diagnosis between mass forming chronic pancreatitis, autoimmune pancreatitis and ductal pancreatic adenocarcinoma. Rev Esp Enferm Dig. 2012;104(6):315-21. https://doi.org/10.4321/S1130-01082012000600006
Lee LS, Andersen DK, Ashida R, Brugge WR, Canto MI, Chang KJ, et al. Endoscopic ultrasound and related technologies for the diagnosis and treatment of pancreatic disease - Research gaps and opportunities: Summary of a National Institute of Diabetes and Digestive and Kidney Diseases Workshop. Pancreas. 2017;46(10):1242-50. https://doi.org/10.1097/MPA.0000000000000936
Bhatia V, Varadarajulu S. Endoscopic ultrasonography-guided tissue acquisition: How to achieve excellence. Dig Endosc. 2017;29(4):417-30. https://doi.org/10.1111/den.12823
Huang JYL, Chang KJ. Improvements and innovations in endoscopic ultrasound guided fine needle aspiration. J Hepatobiliary Pancreat Sci. 2015;22(7):E37-E46. https://doi.org/10.1002/jhbp.232
Dumonceau JM, Koessler T, van Hooft Jeanin E, Fockens P. Endoscopic ultrasonography-guided fine needle aspiration: Relatively low sensitivity in the endosonographer population. World J Gastroenterol. 2012;18(19):2357-63. https://doi.org/10.3748/wjg.v18.i19.2357
Jhala NC, Jhala DN, Chhieng DC, Eloubeidi MA, Eltoum IA. Endoscopic ultrasound-guided fine-needle aspiration: A cytopathologist’s perspective. Am J Clin Pathol. 2003;120(3):351-67. https://doi.org/ 10.1309/MFRF-J0XY-JLN8-NVDP
Dumonceau JM, Deprez PH, Jenssen C, Iglesias-García J, Larghi A, Vanbiervliet G, et al. Indications, results, and clinical impact of endoscopic ultrasound (EUS)-guided sampling in gastroenterology: European Society of Gastrointestinal Endoscopy (ESGE) Clinical Guideline - Updated January 2017. Endoscopy. 2017;49(7):695-714. https://doi.org/10.1055/s-0043-109021
Polkowski M, Larghi A, Weynand B, Boustière C, Giovannini M, Pujol B, et al. Learning, techniques, and complications of endoscopic ultrasound (EUS)-guided sampling in gastroenterology: European Society of Gastrointestinal Endoscopy (ESGE) technical guideline. Endoscopy. 2012;44(2):190-205. https://doi.org/10.1055/s-0031-1291543
Iglesias-García J, Lindkvist B, Lariño-Noia J, Domínguez-Muñoz JE. Endoscopic ultrasound elastography. Endosc Ultrasound. 2012;1(1):8-16. https://doi.org/10.7178/eus.01.003
GBD 2017 Pancreatic Cancer Collaborators. The global, regional, and national burden of pancreatic cancer and its attributable risk factors in 195 countries and territories, 1990-2017: A systematic analysis for the Global Burden of Disease Study 2017. Lancet Gastroenterol Hepatol. 2019;4(12):934-47. https://doi.org/10.1016/S2468-1253(19)30347-4
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2020. CA Cancer J Clin. 2020;70(1):7-30. https://doi.org/10.3322/caac.21590
Pardo C, Cendales R. Cancer incidence estimates and mortality for the top five cancer in Colombia, 2007-2011. Colomb Med (Cali). 2018;49(1):16-22. https://doi.org/10.25100/cm.v49i1.3596
Mondal U, Henkes N, Patel S, Rosenkranz L. Endoscopic ultrasound elastography: Current clinical use in pancreas. Pancreas. 2016;45(7):929-33. https://doi.org/10.1097/MPA.0000000000000595
Itokawa F, Itoi T, Sofuni A, Kurihara T, Tsuchiya T, Ishii K, et al. EUS elastography combined with the strain ratio of tissue elasticity for diagnosis of solid pancreatic masses. J Gastroenterol. 2011;46(6):843-53. https://doi.org/10.1007/s00535-011-0399-5
Okasha HH, Mahdy RE, Elkholy S, Hassan MS, El-Mazny AN, Hadad KEE, et al. Endoscopic ultrasound (EUS) elastography and strain ratio, could it help in differentiating malignant from benign pancreatic lesions? Medicine. 2018;97(36):e11689. https://doi.org/10.1097/MD.0000000000011689
Pérez-Cruz PE, Acevedo F. Escalas de estado funcional (o performance status) en cáncer. Gastroenterol Latinoam. 2014;25(3):219-26.
Wani S, Wallace MB, Cohen J, Pike IM, Adler DG, Kochman ML, et al. Quality indicators for EUS. Gastrointest Endosc. 2015;81(1):67-80. https://doi.org/10.1016/j.gie.2014.07.054
Cui XW, Chang JM, Kan QC, Chiorean L, Ignee A, Dietrich CF. Endoscopic ultrasound elastography: Current status and future perspectives. World J Gastroenterol. 2015;21(47):13212-24. https://doi.org/10.3748/wjg.v21.i47.13212
Dietrich CF. Elastography, the new dimension in ultrasonography. Praxis (Bern 1994). 2011;100(25):1533-42. https://doi.org/10.1024/1661-8157/a000735
Krouskop TA, Wheeler TM, Kallel F, Garra BS, Hall T. Elastic moduli of breast and prostate tissues under compression. Ultrason Imaging. 1998;20(4):260-74. https://doi.org/10.1177/016173469802000403
Wang D, Yu X, Xiao W, Jiao X, Wu J, Teng D, et al. Prevalence and clinical characteristics of fatty pancreas in Yangzhou, China: A cross-sectional study. Pancreatology. 2018;18(3):263-8. https://doi.org/10.1016/j.pan.2018.02.004
Lesmana CRA, Pakasi LS, Inggriani S, Aidawati ML, Lesmana LA. Prevalence of non-alcoholic fatty pancreas disease (NAFPD) and its risk factors among adult medical check-up patients in a private hospital: A large cross sectional study. BMC Gastroenterol. 2015;15(1):174. https://doi.org/10.1186/s12876-015-0404-1
Lee JS, Kim SH, Jun DW, Han JH, Jang EC, Park JY, et al. Clinical implications of fatty pancreas: Correlations between fatty pancreas and metabolic syndrome. World J Gastroenterol. 2009;15(15):1869-75. https://doi.org/10.3748/wjg.15.1869
Liles JS, Katz MH. Pancreaticoduodenectomy with vascular resection for pancreatic head adenocarcinoma. Expert Rev Anticancer Ther. 2014;14(8):919-29. https://doi.org/10.1586/14737140.2014.919860
Lesmana CRA, Gani RA, Lesmana LA. Non-alcoholic fatty pancreas disease as a risk factor for pancreatic cancer based on endoscopic ultrasound examination among pancreatic cancer patients: A single-center experience. JGH Open. 2017;2(1):4-7. https://doi.org/10.1002/jgh3.12032
Descargas
Publicado
Cómo citar
Número
Sección
Licencia
Derechos de autor 2022 Revista colombiana de Gastroenterología

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial-SinDerivadas 4.0.
Aquellos autores/as que tengan publicaciones con esta revista, aceptan los términos siguientes:
Los autores/as ceden sus derechos de autor y garantizarán a la revista el derecho de primera publicación de su obra, el cuál estará simultáneamente sujeto a la Licencia de reconocimiento de Creative Commons que permite a terceros compartir la obra siempre que se indique su autor y su primera publicación en esta revista.
Los contenidos están protegidos bajo una licencia de Creative Commons Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional.


| Estadísticas de artículo | |
|---|---|
| Vistas de resúmenes | |
| Vistas de PDF | |
| Descargas de PDF | |
| Vistas de HTML | |
| Otras vistas | |