No inferioridad entre dos agentes de bajo volumen (Picosulfato de Sodio/Citrato de Magnesio vs. Sulfato de Sodio/Potasio/Magnesio) en la preparación de colon para procedimientos diagnósticos: estudio observacional
DOI:
https://doi.org/10.22516/25007440.545Palavras-chave:
Neoplasias colorrectales, picosulfato de sodio, preparación intestinal, evidencia en vida realResumo
Introducción: el cáncer colorrectal es un problema de salud pública; sin embargo, la detección temprana reduce su morbimortalidad. La colonoscopia es el procedimiento de elección para detectar lesiones premalignas y el éxito depende de una limpieza adecuada. El objetivo es evaluar el desempeño de dos preparaciones de bajo volumen empleados en un hospital de alto nivel.
Materiales y métodos: estudio prospectivo en adultos que asistieran a colonoscopia en la Fundación Santa Fe de Bogotá, Colombia. Las preparaciones se evaluaron con la escala de Boston, con puntaje ≥ 6 puntos para una limpieza adecuada. Se realizó un análisis de regresión logística para establecer la efectividad de los medicamentos con un cálculo de no inferioridad del 3 %-5 %.
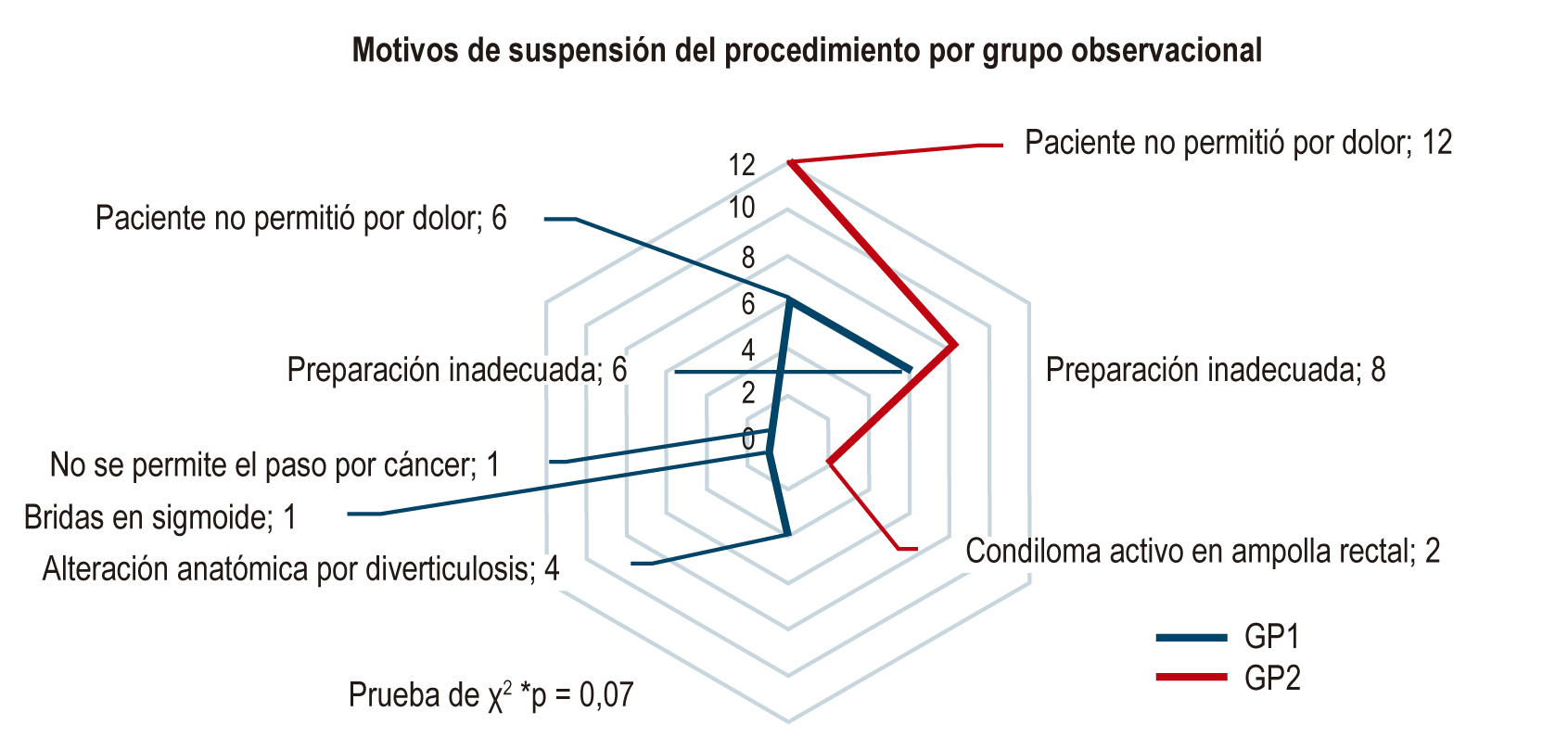
Resultados: 598 pacientes fueron evaluados. El 49 % (293) fue expuesto al picosulfato de sodio/citrato de magnesio y el 51 % (305) fue expuesto al sulfato de sodio/potasio/magnesio. Con un promedio de Boston de 6,98 ± 1,86 (78 % con puntaje de Boston ≥ 6) y 7,39 ± 1,83 (83 %), respectivamente (p = 0,649). Según el análisis de la presencia y frecuencia de síntomas no deseados, el picosulfato fue mejor tolerado (p < 0,001).
Conclusiones: los estudios de preparación intestinal en pacientes de un escenario real son muy escasos.
Los medicamentos de bajo volumen obtuvieron una efectividad global y por segmento de colon similar, confirmando la no-inferioridad; el picosulfato de sodio/citrato de magnesio fue mejor tolerado. Un estudio de costo-efectividad podría definir esto según las necesidades de la población de estudio.
Downloads
Referências
Voiosu T, Tanţău A, Voiosu A, Benguş A, Mocanu C, Smarandache B, Baicuş C, Vişovan I, Mateescu B. Preparation regimen is more important than patient-related factors: a randomized trial comparing a standard bowel preparation before colonoscopy with an individualized approach. Rom J Intern Med. 2017;55(1):36-43.
https://doi.org/10.1515/rjim-2016-0047
Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68(6):394-424. https://doi.org/10.3322/caac.21492
Galán E, Puerto D, Salazar L, Oliveros R, Arredondo L. Manual para la detección temprana del cáncer de colon y recto. Bogotá: Instituto Nacional de Cancerología; 2015.
Maratt JK, Calderwood AH. Colorectal Cancer Screening and Surveillance Colonoscopy in Older Adults. Curr Treat Options Gastroenterol. 2019;17(2):292-302.
https://doi.org/10.1007/s11938-019-00230-9
Atkin WS, Edwards R, Kralj-Hans I, Wooldrage K, Hart AR, Northover JM, Parkin DM, Wardle J, Duffy SW, Cuzick J; UK Flexible Sigmoidoscopy Trial Investigators. Once-only flexible sigmoidoscopy screening in prevention of colorectal cancer: a multicentre randomised controlled trial. The Lancet. 2010;375(9726):1624-33.
https://doi.org/10.1016/S0140-6736(10)60551-X
Baxter NN, Warren JL, Barrett MJ, Stukel TA, Doria-Rose VP. Association Between Colonoscopy and Colorectal Cancer Mortality in a US Cohort According to Site of Cancer and Colonoscopist Specialty. J Clin Oncol. 2012;30(21):2664-9.
https://doi.org/10.1200/JCO.2011.40.4772
Segnan N, Armaroli P, Bonelli L, Risio M, Sciallero S, Zappa M, Andreoni B, Arrigoni A, Bisanti L, Casella C, Crosta C, Falcini F, Ferrero F, Giacomin A, Giuliani O, Santarelli A, Visioli CB, Zanetti R, Atkin WS, Senore C; SCORE Working Group. Once-Only Sigmoidoscopy in Colorectal Cancer Screening: Follow-up Findings of the Italian Randomized Controlled Trial--SCORE. JNCI J Natl Cancer Inst. 2011;103(17):1310-22.
https://doi.org/10.1093/jnci/djr284
Flemming JA, Vanner SJ, Hookey LC. Split-dose picosulfate, magnesium oxide, and citric acid solution markedly enhances colon cleansing before colonoscopy: a randomized, controlled trial. Gastrointest Endosc. 2012;75(3):537-544.e1.
https://doi.org/10.1016/j.gie.2011.09.018
le Clercq CMC, Bouwens MWE, Rondagh EJA, Bakker CM, Keulen ETP, de Ridder RJ, Winkens B, Masclee AA, Sanduleanu S. Postcolonoscopy colorectal cancers are preventable: a population-based study. Gut. 2014;63(6):957-63.
https://doi.org/10.1136/gutjnl-2013-304880
Cortes BGW, Cabral RM, Carmo GAA do, Queiroz FL de, Leite SM de O, Andrade AC de S, Ferreira A, Alcici MA, Cortes M. Double blinded randomized clinical trial to assess the effectiveness of several preparations for colonoscopy. J Coloproctology. 2018;38(4):302-8.
https://doi.org/10.1016/j.jcol.2018.07.001
Hassan C, Rossi PG, Camilloni L, Rex DK, Jimenez-Cendales B, Ferroni E, Borgia P, Zullo A, Guasticchi G; HTA Group. Meta-analysis: adherence to colorectal cancer screening and the detection rate for advanced neoplasia, according to the type of screening test. Aliment Pharmacol Ther. 2012;36(10):929-40.
https://doi.org/10.1111/apt.12071
Marzo M Castells, A, Bellas B. Guía de práctica clínica sobre la prevención del cáncer colorrectal. Gastroentorol Hepatol. 2004;10:579-634.
https://doi.org/10.1016/S0210-5705(03)70535-4
Schreiber S, Baumgart D, Drenth J, Filip R, Clayton L, Hylands K, Berton A, Salvatore G, Denaro V. Colon cleansing efficacy and safety with 1 L NER1006 versus sodium picosulfate with magnesium citrate: a randomized phase 3 trial. Endoscopy. 2019;51(01):73-84.
https://doi.org/10.1055/a-0639-5070
Oh CH, Lee CK, Kim J-W, Shim J-J, Jang JY. Suboptimal Bowel Preparation Significantly Impairs Colonoscopic Detection of Non-polypoid Colorectal Neoplasms. Dig Dis Sci. 2015;60(8):2294-303.
https://doi.org/10.1007/s10620-015-3628-6
Lieberman DA, Rex DK, Winawer SJ, Giardiello FM, Johnson DA, Levin TR. Guidelines for Colonoscopy Surveillance After Screening and Polypectomy: A Consensus Update by the US Multi-Society Task Force on Colorectal Cancer. Gastroenterology. 2012;143(3):844-57. https://doi.org/10.1053/j.gastro.2012.06.001
Chokshi RV, Hovis CE, Hollander T, Early DS, Wang JS. Prevalence of missed adenomas in patients with inadequate bowel preparation on screening colonoscopy. Gastrointest Endosc. 2012;75(6):1197-203.
https://doi.org/10.1016/j.gie.2012.01.005
Krajicek E, Fischer M, Allegretti JR, Kelly CR. Nuts and Bolts of Fecal Microbiota Transplantation. Clin Gastroenterol Hepatol. 2019;17(2):345-52.
https://doi.org/10.1016/j.cgh.2018.09.029
Rutherford CC, Calderwood AH. Update on Bowel Preparation for Colonoscopy. Curr Treat Options Gastroenterol. 2018;16(1):165-81.
https://doi.org/10.1007/s11938-018-0165-3
Chaussade S, Schmöcker C, Toulemonde P, Muñoz-Navas M, O’Mahony V, Henri F. Phosphate tablets or polyethylene glycol for preparation to colonoscopy? A multicentre non-inferiority randomized controlled trial. Surg Endosc. 2017;31(5):2166-73.
https://doi.org/10.1007/s00464-016-5214-1
Munsterman ID, Cleeren E, van der Ploeg T, Brohet R, van der Hulst R. ‘Pico-Bello-Klean study’: effectiveness and patient tolerability of bowel preparation agents sodium picosulphate-magnesium citrate and polyethylene glycol before colonoscopy. A single-blinded randomized trial. Eur J Gastroenterol Hepatol. 2015;27(1):29-38.
https://doi.org/10.1097/MEG.0000000000000192
Gweon T-G, Kim SW, Noh Y-S, Hwang S, Kim N-Y, Lee Y, Lee SW, Lee SW, Lee JY, Lim CH, Hun Kim H, Kim JS, Kyung Cho Y, Myung Park J, Seok Lee I, Myung-Gyu Choi. Prospective, Randomized Comparison of Same-Day Dose of 2 Different Bowel Cleanser for Afternoon Colonoscopy: Picosulfate, Magnesium Oxide, and Citric Acid Versus Polyethylene Glycol. Medicine (Baltimore). 2015;94(13):e628.
https://doi.org/10.1097/MD.0000000000000628
Jeon SR, Kim HG, Lee JS, Kim J-O, Lee TH, Cho J-H, Kim YH, Cho JY, Lee JS. Randomized controlled trial of low-volume bowel preparation agents for colonic bowel preparation: 2-L polyethylene glycol with ascorbic acid versus sodium picosulfate with magnesium citrate. Int J Colorectal Dis. 2015;30(2):251-8.
https://doi.org/10.1007/s00384-014-2066-9
Martel M, Barkun AN, Menard C, Restellini S, Kherad O, Vanasse A. Split-Dose Preparations Are Superior to Day-Before Bowel Cleansing Regimens: A Meta-analysis. Gastroenterology. 2015;149(1):79-88.
https://doi.org/10.1053/j.gastro.2015.04.004
Hosoe N, Nakashita M, Imaeda H, Sujino T, Bessho R, Ichikawa R, Inoue N, Kanai T, Hibi T, Ogata H. Comparison of patient acceptance of sodium phosphate versus polyethylene glycol plus sodium picosulfate for colon cleansing in Japanese: Patient acceptance for laxative. J Gastroenterol Hepatol. 2012;27(10):1617-22.
https://doi.org/10.1111/j.1440-1746.2012.07190.x
Wexner SD, Force T, Beck DE, Baron TH, Fanelli RD, Hyman N, Wasco KE; American Society of Colon and Rectal Surgeons; American Society for Gastrointestinal Endoscopy; Society of American Gastrointestinal and Endoscopic Surgeons. A consensus document on bowel preparation before colonoscopy: Prepared by a Task Force From The American Society of Colon and Rectal Surgeons (ASCRS), the American Society for Gastrointestinal Endoscopy (ASGE), and the Society of American Gastrointestinal and Endoscopic Surgeons (SAGES). Gastrointest Endosc. 2006;63(7):894-909.
https://doi.org/10.1016/j.gie.2006.03.918
Landreneau SW, Di Palma JA. Update on Preparation for Colonoscopy. Curr Gastroenterol Rep. 2010;12(5):366-73. https://doi.org/10.1007/s11894-010-0121-4
Weir MA, Fleet JL, Vinden C, Shariff SZ, Liu K, Song H, Jain AK, Gandhi S, Clark WF, Garg AX. Hyponatremia and Sodium Picosulfate Bowel Preparations in Older Adults. Am J Gastroenterol. 2014;109(5):686-94.
https://doi.org/10.1038/ajg.2014.20
Gandhi S, Shariff SZ, Fleet JL, Weir MA, Jain AK, Garg AX. Validity of the International Classification of Diseases 10th revision code for hospitalisation with hyponatraemia in elderly patients. BMJ Open. 2012;2(6):e001727.
https://doi.org/10.1136/bmjopen-2012-001727
Calderwood AH, Jacobson BC. Comprehensive validation of the Boston Bowel Preparation Scale. Gastrointest Endosc. 2010;72(4):686-92.
https://doi.org/10.1016/j.gie.2010.06.068
Chaves Marques S. The Boston Bowel Preparation Scale: Is It Already Being Used? GE - Port J Gastroenterol. 2018;25(5):219-21.
https://doi.org/10.1159/000486805
Massinha P, Almeida N, Cunha I, Tomé L. Clinical Practice Impact of the Boston Bowel Preparation Scale in a European Country. GE - Port J Gastroenterol. 2018;25(5):230-5.
https://doi.org/10.1159/000485567
Declaración de Helsinki de la AMM - Principios éticos para las investigaciones médicas en seres humanos. Asociación Médica Mundial; 2017.
Resolución número 8430 de 1993. Por la cual se establecen las normas científicas, técnicas y administrativas para la investigación en salud. Ministerio de Salud (4 de octubre de 1993).
Resolución No. 2018013725 DE 5 de abril de 2018. Por la cual se concede un Registro Sanitario. Ministerio de Salud, INVIMA (5 de abril de 2018).
Lai EJ, Calderwood AH, Doros G, Fix OK, Jacobson BC. The Boston bowel preparation scale: a valid and reliable instrument for colonoscopy-oriented research. Gastrointest Endosc. 2009;69(3):620-5.
https://doi.org/10.1016/j.gie.2008.05.057
Sullivan KM, Dean AG. OPENEPI [Internet] [acceso el 15 de junio de 2019]. Disponible en: https://www.openepi.com/SampleSize/SSCohort.htm
Gu P, Lew D, Oh SJ, Vipani A, Ko J, Hsu K, Mirakhor E, Pattisapu V, Bullen T, Fuller G, Spiegel BMR, Almario CV. Comparing the Real-World Effectiveness of Competing Colonoscopy Preparations: Results of a Prospective Trial. Am J Gastroenterol. 2019;114(2):305-14.
https://doi.org/10.14309/ajg.0000000000000057
Kim ES, Lee WJ, Jeen YT, Choi HS, Keum B, Seo YS, Chun HJ, Lee HS, Um SH, Kim CD, Ryu HS.A randomized, endoscopist-blinded, prospective trial to compare the preference and efficacy of four bowel-cleansing regimens for colonoscopy. Scand J Gastroenterol. 2014;49(7):871-7. https://doi.org/10.3109/00365521.2014.910543
Basch E, Schrag D. The Evolving Uses of “Real-World” Data. JAMA. 2019;321(14):1359-1360. https://doi.org/10.1001/jama.2019.4064
Kim J, Kim HG, Kim KO, Kim HW, Park J, Byeon JS, Hwang SW, Shin HD, Shin JE, Yang HJ, Lee HS, Jung Y, Cho YS, Joo YE, Myung DS, Huh KC, Ahn EM. Clinical comparison of low-volume agents (oral sulfate solution and sodium picosulfate with magnesium citrate) for bowel preparation: the EASE study. ntest Res. 2019;17(3):413-418. https://doi.org/10.5217/ir.2018.00156
Downloads
Publicado
Como Citar
Edição
Seção
Licença
Aquellos autores/as que tengan publicaciones con esta revista, aceptan los términos siguientes:
Los autores/as ceden sus derechos de autor y garantizarán a la revista el derecho de primera publicación de su obra, el cuál estará simultáneamente sujeto a la Licencia de reconocimiento de Creative Commons que permite a terceros compartir la obra siempre que se indique su autor y su primera publicación en esta revista.
Los contenidos están protegidos bajo una licencia de Creative Commons Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional.


| Métricas do artigo | |
|---|---|
| Vistas abstratas | |
| Visualizações da cozinha | |
| Visualizações de PDF | |
| Visualizações em HTML | |
| Outras visualizações | |