Identificación de biomarcadores sanguíneos para la detección de lesiones premalignas y el diagnóstico del cáncer gástrico
DOI:
https://doi.org/10.22516/25007440.124Palabras clave:
Cáncer gástrico, biomarcadores, prevenciónResumen
Introducción: el cáncer gástrico es muy frecuente en Colombia y es la primera causa de muerte por cáncer. De acuerdo con la cascada de Correa existen unas etapas progresivas en la formación de esta enfermedad, que van de la gastritis, pasando por la atrofia, metaplasia y displasia, hasta el cáncer. En esas etapas intermedias se pudiera detectar y prevenir, pero no existen marcadores en sangre diferentes al pepsinógeno que puedan ayudar a detectar las etapas premalignas ni a diagnosticar el cáncer. Por lo cual, las investigaciones que ayuden a descubrir nuevos biomarcadores son de gran importancia.
Objetivos: el objetivo de este trabajo es identificar marcadores moleculares (perfil de expresión de ARNm) que distingan a los pacientes con condiciones premalignas (atrofia, metaplasia) y cáncer gástrico, de aquellos pacientes que solo tienen gastritis.
Metodología: se tomaron pacientes en cada una de las etapas de la cascada de Correa, los cuales proporcionaron una muestra, previo consentimiento firmado, de 2,5 mL de sangre en ayunas para el análisis de expresión de genes tomadas después de la endoscopia inicial. La sangre se colocó en un tubo de ARN sanguíneo PAXgene; luego, el ARN se extrajo de la sangre y se analizó usando una plataforma de microarrays, los cuales identificaron cambios de expresión de ARN mensajero que permitieron diferenciar cada una de las etapas descritas.
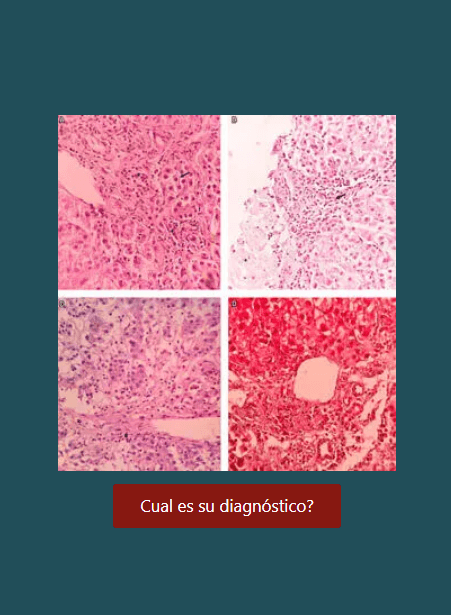
Resultados: se incluyeron 89 pacientes, y en los hallazgos endoscópicos se encontró gastritis crónica antral en 27 pacientes (30,3%), cáncer gástrico avanzado en 25 (28%), pangastritis crónica en 15 (16,8%), cáncer temprano en 7 (7,8%), sospecha de metaplasia intestinal en 6 (6,7%), sospecha de gastritis atrófica en 3 (3,3%) y úlcera péptica en 2 casos (2,2%). Cuando se revisó el informe patológico se halló gastritis crónica en 34 pacientes (22 mujeres), adenocarcinoma intestinal en 20 (4 mujeres), metaplasia intestinal 18 casos (13 mujeres), cáncer tipo difuso en 11 (7 mujeres), displasia de bajo grado en 4 y de alto grado en 1, y atrofia sola en 1 paciente. En el análisis de expresión genética se encontraron 48 genes que permitieron determinar a los pacientes con gastritis crónica de aquellos con cáncer gástrico. También se hallaron 14 genes para diferenciar los pacientes con cáncer difuso de los de tipo intestinal, y un grupo de 48 genes que ayudó a distinguir los pacientes con gastritis crónica de los de metaplasia intestinal.
Conclusiones: este es el primer trabajo en Colombia, y a nivel mundial, que permite identificar nuevos biomarcadores a través de la expresión genética del ARN mensajero, el cual diferencia en sangre las etapas de la cascada de Correa, y permite diagnosticar el cáncer gástrico. Es probable que en un futuro se puedan utilizar como una prueba diagnóstica o de seguimiento.
Descargas
Lenguajes:
esReferencias bibliográficas
IARC/WHO. Globocan 2012: Estimated cancer incidence, mortality and prevalence worldwide in 2012. Available at: http://globocan.iarc.fr/. Accessed March 31, 2014.
Krew KD, Neugut AI. Epidemiology of gastric cancer. World J Gastroenterol. 2006;12:354-62. doi: https://doi.org/10.3748/wjg.v12.i3.354
Hamashima C, Shibuya D, Yamazaki H, et al. The Japanese guidelines for gastric cancer screening. Jpn J Clin Oncol. 2008;38:259-67. doi: https://doi.org/10.1093/jjco/hyn016
https://doi.org/10.1093/jjco/hyn017
Piñeros M, Hernández G, Bray F. Increasing mortality rates of common malignancies in Colombia. Cancer. 2004;101:2285-92. doi: https://doi.org/10.1002/cncr.20607
Correa P, Piazzuelo MB, Camargo MC. Overview and pathology of gastric cancer. En: Wang T, Fox J, Giraud A (editores). The biology of gastric cancers. Springer Science Business Media. 2009. p. 21-446. doi: https://doi.org/10.1007/978-0-387-69182-4_1
Smith MG, Hold GL, Tahara E, et al. Cellular and molecular aspects of gastric cancer. World J Gastroenterol. 2006;12:2979-90. doi: https://doi.org/10.3748/wjg.v12.i19.2979
Moss SF, Malfertheiner P. Helicobacter and gastric malignancies. Helicobacter. 2007;12(1):23-30. doi: https://doi.org/10.1111/j.1523-5378.2007.00539.x
Otero W, Gómez M, Castro D. Carcinogénesis gástrica. Rev Colomb Gastroenterol. 2009;24:314-29.
Jarvi O, Lauren P. On the role of heterotopias of the intestinal epithelium in the pathogenesis of gastric cancer. Acta Pathol Microbiol Scand. 1951;29:26-44. doi: https://doi.org/10.1111/j.1699-0463.1951.tb00101.x
Lauren P. The two histological main types of gastric carcinoma: diffuse and so called intestinal-type carcinoma. An attempt at a histoclinical classification. Acta Pathol Microbiol Scand. 1951;64:31-49.
Correa P, Carneiro F. Classification of gastric carcinomas. Curr Diagn Pathol. 1997;4:51-9. doi: https://doi.org/10.1016/S0968-6053(97)80008-7
Ekstrom AM, Serafini M, Nyren O, et al. Dietary antioxidant intake and the risk of non-cardia cancer of the intestinal and diffuse types: a population based case control study in Sweden. Int J Cancer. 2000;87:133-40. doi: https://doi.org/10.1002/1097-0215(20000701)87:1<133::AID-IJC20>3.0.CO;2-E - https://doi.org/10.1002/1097-0215(20000701)87:1<133::AID-IJC20>3.3.CO;2-5
El-Omar EM, Lochhead P. Gastric cancer. Br Med Bull. 2008;85:87-100. doi: https://doi.org/10.1093/bmb/ldn007
Henson DE, Dittus C, Younes M, et al. Differential trends in the intestinal and diff use topless of gastric carcinoma in the United States-2000: increase in the signet ring cell type. Arch Pathol Lab Med. 2004;128:765-70.
Oliveira C, Seruca R, Carneiro F. Hereditary gastric cancer. Best Pract Res Clin Gastroenterol. 2009;23:147-57. doi: https://doi.org/10.1016/j.bpg.2009.02.003
Alberts SR, Cervantes A, van de Velde CJ. Gastric cancer: epidemiology, pathology and treatment. Ann Oncol. 2003;14(2):ii31-6.
doi: https://doi.org/10.1093/annonc/mdg726
Guilford P, Hopkins J, Harraway J, et al. E-cadherin germ line mutations in familial gastric cancer. Nature. 1998;392:402-5. doi: https://doi.org/10.1038/32918 - https://doi.org/10.1038/31813
Cisco RM, Ford JM, Norton JA. Hereditary diff use gastric cancer. Cancer. 2008;113(7):1850-6. doi: https://doi.org/10.1002/cncr.23650
Masciari S, Larsson N, Senz J, et al. Germline E-cadherin mutations in familial lobular breast cancer. J Med Genet. 2007;44:726-31. doi: https://doi.org/10.1136/jmg.2007.051268
Malfertheiner P, Megraud F, O´Morain CA, et al. Management of Helicobacter pylori infection-The Maastricht IV/Florence Consensus Report. Gut. 2012;61:646-64. doi: https://doi.org/10.1136/gutjnl-2012-302084
Correa P. Helicobacter pylori and gastric carcinogenesis. Am J Surg Pathol. 1995;19(1):S37-S43.
Bornschein J, Malfetheiner P. Gastric carcinogensis. Langenbecks Arch Surg. 2011;396:729-42. doi: https://doi.org/10.1007/s00423-011-0810-y
Correa P, Houghton J. Carcinogenesis of Helicobacter pylori. Gastroenterology. 2007;133:659-72. doi: https://doi.org/10.1053/j.gastro.2007.06.026
Graham DY, Asaka M. Eradication of gastric cancer and more efficient gastric cancer surveillance in Japan: two peas in a pod. J Gastroenterol. 2010;45:1-8. doi: https://doi.org/10.1007/s00535-009-0117-8
Piazuelo B, Epplein M, Correa P. Gastric cancer: an infectious disease. Infect Dis Clin N Am. 2010;24:853-69. doi: https://doi.org/10.1016/j.idc.2010.07.010
Guo J, Miao Y, Xiao B, et al. Differential expression of micro RNA species in human gastric cancer versus non-tumorous tissues. J Gastroenterol Hepatol. 2009;24:652-7. doi: https://doi.org/10.1111/j.1440-1746.2008.05666.x
Liu Y, Zeng G. Cancer and innate immune system interactions: translational potentials for cancer immunotherapy. J Immunother. 2012;35(4):299-308. doi: https://doi.org/10.1097/CJI.0b013e3182518e83
Grivennikov I, Florian G, Karin M. Immunity, inflammation, and cancer. Cell. 2010;140(6):883-99. doi: https://doi.org/10.1016/j.cell.2010.01.025
MAQC Consortium. The Microarray Quality Control (MAQC) project shows inter- and intraplatform reproducibility of gene expression measurements. Nat Biotechnol. 2006;24:1151-61. doi: https://doi.org/10.1038/nbt1239
Palayoor T, Aryankalayil M, Makinde A, et al. Differential expression of stress and immune response pathway transcripts and miRNAs in normal human endothelial cells subjected to fractionated or single-dose radiation. Mol Cancer Res. 2014;12(7):1002-15. doi: https://doi.org/10.1158/1541-7786.MCR-13-0623
Martínez T, Bravo M, Núnez D, et al. Niveles séricos de pepsinógeno y su capacidad diagnóstica de atrofia gástrica en diferentes poblaciones colombianas. Rev Colomb Cancerol. 2014;18(4).
Danesh J. Helicobacter pylori infection and gastric cancer: systematic review of the epidemiological studies. Aliment Pharmacol Ther. 1999;13:851-6. doi: https://doi.org/10.1046/j.1365-2036.1999.00546.x
Cassaro M, Rugge M, Gutierrez O, et al. Topographic patterns of intestinal metaplasia and gastric cancer. Am J Gastroenterol. 2000;95:1431-8. doi: https://doi.org/10.1111/j.1572-0241.2000.02074.x
El-Zimaity HM, Ramchatesingh J, Saeed MA, et al. Gastric intestinal metaplasia: subtypes and natural history. J Clin Pathol. 2001;54:679-83. doi: https://doi.org/10.1136/jcp.54.9.679
Descargas
Publicado
Cómo citar
Número
Sección
Licencia
Aquellos autores/as que tengan publicaciones con esta revista, aceptan los términos siguientes:
Los autores/as ceden sus derechos de autor y garantizarán a la revista el derecho de primera publicación de su obra, el cuál estará simultáneamente sujeto a la Licencia de reconocimiento de Creative Commons que permite a terceros compartir la obra siempre que se indique su autor y su primera publicación en esta revista.
Los contenidos están protegidos bajo una licencia de Creative Commons Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional.

| Estadísticas de artículo | |
|---|---|
| Vistas de resúmenes | |
| Vistas de PDF | |
| Descargas de PDF | |
| Vistas de HTML | |
| Otras vistas | |