Hepatocarcinoma: experiencia de la vida real en un centro especializado de Bogotá, Colombia
DOI:
https://doi.org/10.22516/25007440.823Palabras clave:
Hepatocarcinoma, vida real, sobrevida, SorafenibResumen
Introducción: el hepatocarcinoma (HCC) es el tumor hepático primario maligno más frecuente en el mundo: en 2018 ocupó la sexta posición y representó la cuarta causa de muerte por cáncer; la supervivencia global a 5 años es del 18 %. La mayoría de los casos de HCC se desarrolla en pacientes con cirrosis de cualquier etiología, especialmente por virus de la hepatitis B y C, alcohol y, recientemente, por la esteatohepatitis no alcohólica (NASH).
Objetivo: analizar las características clínicas, métodos de diagnóstico, tratamientos, variables pronósticas y supervivencia.
Metodología: estudio descriptivo retrospectivo de una cohorte de pacientes con diagnóstico de cirrosis atendidos entre enero de 2011 y diciembre de 2020 en un centro de atención médica de Bogotá, con diagnóstico de HCC confirmado radiológicamente o por biopsia. La información se analizó de forma descriptiva con medidas de frecuencia absoluta en el caso de las variables categóricas; para las variables continuas se resumió la información con medidas de tendencia central (media o medianas) y su respectiva medida de dispersión.
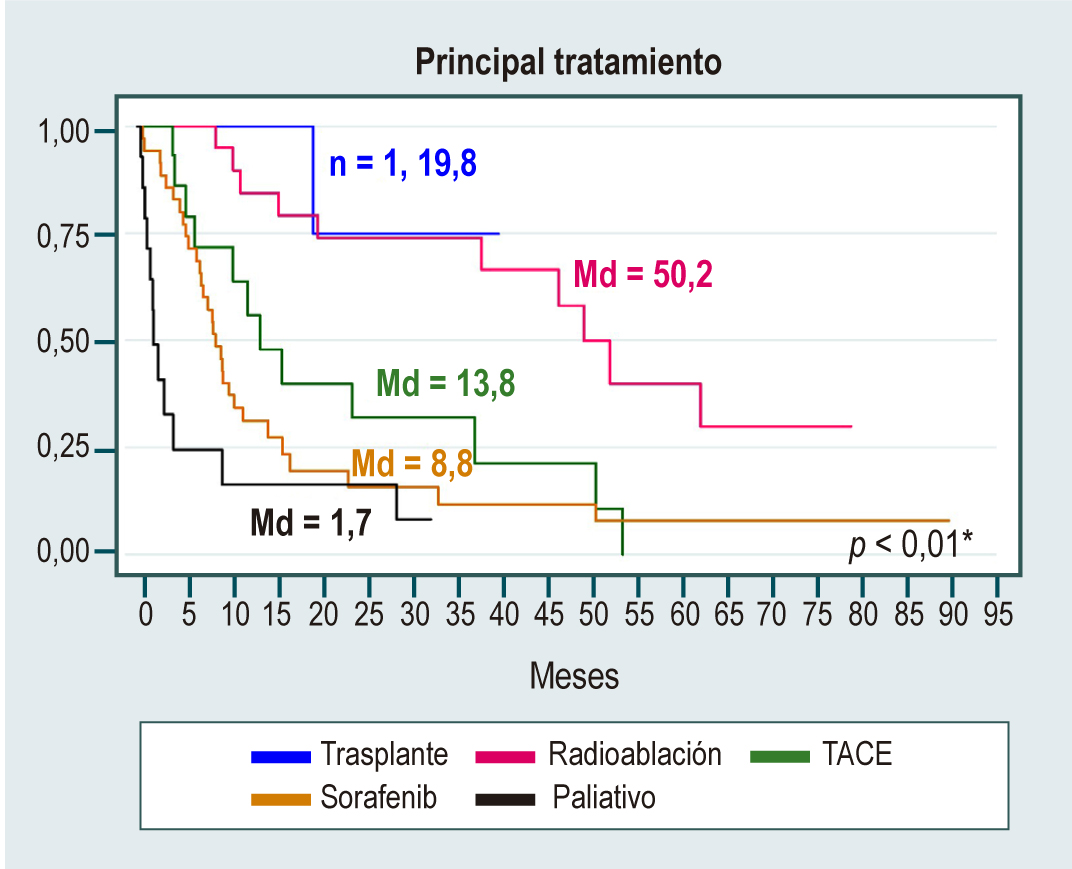
Resultados: se incluyeron 152 pacientes diagnosticados con HCC, con edad promedio de 69,4 años, 51,3 % eran hombres. La principal causa de HCC fue el hígado graso no alcohólico (NAFLD), que representó casi una tercera parte de los casos (32 %); otras causas fueron el alcohol (15 %) y el virus de la hepatitis C (14 %). La mediana de presentación del tumor fue de 2 nódulos con un tamaño cercano a 4 cm. El 35 % de los pacientes tenía un estadio BCLC (Barcelona Clinic Liver Cancer) con opciones curativas y el 25 % de los pacientes recibió opciones curativas de tratamiento. La terapia sistémica de primera línea utilizada en esta cohorte fue el sorafenib®, que se utilizó en 35 pacientes (33,7 %). Las curvas de supervivencia mostraron que las mujeres, el estadio Child-Pugh A y el estadio BCLC 0 presentaron mayores medianas de supervivencia. El análisis multivariado evidenció un mayor riesgo de muerte al ser hombre (Hazard ratio [HR]: 2,16; intervalo de confianza [IC]: 1,24 a 3,76), estar en los estadios Child-Pugh B (HR: 2,14; IC: 1,16 a 3,95) y Child-Pugh C (HR: 7,52; IC: 2,88 a 19,57).
Conclusiones: el NAFLD es la principal causa de HCC en la presente cohorte, una tercera parte de los pacientes se diagnostica en estadios BCLC tempranos con opción curativa de tratamiento, y un 25 % se trata con terapias curativas. El sorafenib fue la terapia de primera línea en HCC avanzado. La supervivencia global luego del diagnóstico de HCC sigue siendo baja, y es necesario aunar esfuerzos en el seguimiento de los pacientes con cirrosis para mejorar estos resultados.
Descargas
Referencias bibliográficas
Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68(6):394-424. https://doi.org/10.3322/caac.21492
Global Burden of Disease Liver Cancer Collaboration, Akinyemiju T, Abera S, Ahmed M, Alam N, Alemayohu MA, et al. The Burden of Primary Liver Cancer and Underlying Etiologies From 1990 to 2015 at the Global, Regional, and National Level: Results From the Global Burden of Disease Study 2015. JAMA Oncol. 2017;3(12):1683-1691. https://doi.org/10.1001/jamaoncol.2017.3055
Jemal A, Ward EM, Johnson CJ, Cronin KA, Ma J, Ryerson B, et al. Annual Report to the Nation on the Status of Cancer, 1975-2014, Featuring Survival. J Natl Cancer Inst. 2017;109(9):djx030. https://doi.org/10.1093/jnci/djx030
Kulik L, El-Serag HB. Epidemiology and Management of Hepatocellular Carcinoma. Gastroenterology. 2019;156(2):477-491.e1. https://doi.org/10.1053/j.gastro.2018.08.065
Pardo C, de Vries E, Buitrago L, Gamboa O. Atlas de mortalidad por cáncer en Colombia. 4.a edición. Bogotá D. C.: Instituto Nacional de Cancerología; 2017. p. 124.
Fattovich G, Stroffolini T, Zagni I, Donato F. Hepatocellular carcinoma in cirrhosis: incidence and risk factors. Gastroenterology. 2004;127(5 Suppl 1):S35-50. https://doi.org/10.1053/j.gastro.2004.09.014
Kanwal F, Hoang T, Kramer JR, Asch SM, Goetz MB, Zeringue A, et al. Increasing prevalence of HCC and cirrhosis in patients with chronic hepatitis C virus infection. Gastroenterology. 2011;140(4):1182-1188.e1. https://doi.org/10.1053/j.gastro.2010.12.032
El-Serag HB. Hepatocellular carcinoma. N Engl J Med. 2011;365(12):1118-27. https://doi.org/10.1056/NEJMra1001683
Sangiovanni A, Prati GM, Fasani P, Ronchi G, Romeo R, Manini M, et al. The natural history of compensated cirrhosis due to hepatitis C virus: A 17-year cohort study of 214 patients. Hepatology. 2006;43(6):1303-10. https://doi.org/10.1002/hep.21176
Suresh D, Srinivas AN, Kumar DP. Etiology of Hepatocellular Carcinoma: Special Focus on Fatty Liver Disease. Front Oncol. 2020;10:601710. https://doi.org/10.3389/fonc.2020.601710
Makarova-Rusher OV, Altekruse SF, McNeel TS, Ulahannan S, Duffy AG, Graubard BI, et al. Population attributable fractions of risk factors for hepatocellular carcinoma in the United States. Cancer. 2016;122(11):1757-65. https://doi.org/10.1002/cncr.29971
Bruix J, Sherman M, Llovet JM, Beaugrand M, Lencioni R, Burroughs AK, et al. Clinical management of hepatocellular carcinoma. Conclusions of the Barcelona-2000 EASL conference. European Association for the Study of the Liver. J Hepatol. 2001;35(3):421-30. https://doi.org/10.1016/s0168-8278(01)00130-1
Bruix J, Sherman M; Practice Guidelines Committee, American Association for the Study of Liver Diseases. Management of hepatocellular carcinoma. Hepatology. 2005;42(5):1208-36. https://doi.org/10.1002/hep.20933
Matsui O, Kobayashi S, Sanada J, Kouda W, Ryu Y, Kozaka K, et al. Hepatocelluar nodules in liver cirrhosis: hemodynamic evaluation (angiography-assisted CT) with special reference to multi-step hepatocarcinogenesis. Abdom Imaging. 2011;36(3):264-72. https://doi.org/10.1007/s00261-011-9685-1
Marrero JA, Kulik LM, Sirlin CB, Zhu AX, Finn RS, Abecassis MM, et al. Diagnosis, Staging, and Management of Hepatocellular Carcinoma: 2018 Practice Guidance by the American Association for the Study of Liver Diseases. Hepatology. 2018;68(2):723-750. https://doi.org/10.1002/hep.29913
European Association for the Study of the Liver. Electronic address: easloffice@easloffice.eu; European Association for the Study of the Liver. EASL Clinical Practice Guidelines: Management of hepatocellular carcinoma. J Hepatol. 2018;69(1):182-236. https://doi.org/10.1016/j.jhep.2018.03.019
Heimbach JK, Kulik LM, Finn RS, Sirlin CB, Abecassis MM, Roberts LR, et al. AASLD guidelines for the treatment of hepatocellular carcinoma. Hepatology. 2018;67(1):358-380. https://doi.org/10.1002/hep.29086
Llovet JM, Di Bisceglie AM, Bruix J, Kramer BS, Lencioni R, Zhu AX, et al. Design and endpoints of clinical trials in hepatocellular carcinoma. J Natl Cancer Inst. 2008;100(10):698-711. https://doi.org/10.1093/jnci/djn134
Forner A, Reig M, Bruix J. Hepatocellular carcinoma. Lancet. 2018;391(10127):1301-1314. https://doi.org/10.1016/S0140-6736(18)30010-2
Jha RC, Mitchell DG, Weinreb JC, Santillan CS, Yeh BM, Francois R, et al. LI-RADS categorization of benign and likely benign findings in patients at risk of hepatocellular carcinoma: a pictorial atlas. AJR Am J Roentgenol. 2014;203(1):W48-69. https://doi.org/10.2214/AJR.13.12169
Debes JD, Chan AJ, Balderramo D, Kikuchi L, Gonzalez Ballerga E, Prieto JE, et al. Hepatocellular carcinoma in South America: Evaluation of risk factors, demographics and therapy. Liver Int. 2018;38(1):136-143. https://doi.org/10.1111/liv.13502
White DL, Thrift AP, Kanwal F, Davila J, El-Serag HB. Incidence of Hepatocellular Carcinoma in All 50 United States, From 2000 Through 2012. Gastroenterology. 2017;152(4):812-820.e5. https://doi.org/10.1053/j.gastro.2016.11.020
Prieto JE, Sánchez S, Prieto RG, Rojas E, González L, Mendivelso F. Características clínicas y descompensación en pacientes con cirrosis hepática atendidos en dos centros de hepatología en la ciudad de Bogotá D.C., 2010-2014. Rev Col Gastroenterol. 2016;31(1):1-8. https://doi.org/10.22516/25007440.66
Prieto-Ortiz JE, Garzón-Orjuela N, Sánchez Pardo S, Prieto-Ortiz RG, Eslava-Schmalbach J. Sobrevida en pacientes con cirrosis de acuerdo con su etiología. Cohorte retrospectiva. Rev Colomb Gastroenterol. 2022;37(1):24-32. https://doi.org/10.22516/25007440.703
Marín-Zuluaga JI, Vergara-Cadavid J, Cajiao-Castro L, Arroyave-Zuluaga D, Castro-Sánchez S, Ceballos-Ramírez L, et al. Caracterización, manejo y pronóstico de una cohorte de pacientes cirróticos con carcinoma hepatocelular. Hospital Pablo Tobón Uribe 2012-2018. Hepatología. 2020;1(2):134-44.
Younossi ZM, Koenig AB, Abdelatif D, Fazel Y, Henry L, Wymer M. Global epidemiology of nonalcoholic fatty liver disease-Meta-analytic assessment of prevalence, incidence, and outcomes. Hepatology. 2016;64(1):73-84. https://doi.org/10.1002/hep.28431
Singal AG, Lampertico P, Nahon P. Epidemiology and surveillance for hepatocellular carcinoma: New trends. J Hepatol. 2020;72(2):250-261. https://doi.org/10.1016/j.jhep.2019.08.025
Ascha MS, Hanouneh IA, Lopez R, Tamimi TA, Feldstein AF, Zein NN. The incidence and risk factors of hepatocellular carcinoma in patients with nonalcoholic steatohepatitis. Hepatology. 2010;51(6):1972-8. https://doi.org/10.1002/hep.23527
Kanwal F, Kramer JR, Mapakshi S, Natarajan Y, Chayanupatkul M, Richardson PA, et al. Risk of Hepatocellular Cancer in Patients With Non-Alcoholic Fatty Liver Disease. Gastroenterology. 2018;155(6):1828-1837.e2. https://doi.org/10.1053/j.gastro.2018.08.024
A new prognostic system for hepatocellular carcinoma: a retrospective study of 435 patients: the Cancer of the Liver Italian Program (CLIP) investigators. Hepatology. 1998;28(3):751-5. https://doi.org/10.1002/hep.510280322
Llovet JM, Ricci S, Mazzaferro V, Hilgard P, Gane E, Blanc JF, et al. Sorafenib in advanced hepatocellular carcinoma. N Engl J Med. 2008;359(4):378-90. https://doi.org/10.1056/NEJMoa0708857
Bruix J, Qin S, Merle P, Granito A, Huang YH, Bodoky G, et al. Regorafenib for patients with hepatocellular carcinoma who progressed on sorafenib treatment (RESORCE): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. 2017;389(10064):56-66. https://doi.org/10.1016/S0140-6736(16)32453-9
Leal CRG, Magalhães C, Barbosa D, Aquino D, Carvalho B, Balbi E, et al. Survival and tolerance to sorafenib in Child-Pugh B patients with hepatocellular carcinoma: a prospective study. Invest New Drugs. 2018;36(5):911-918. https://doi.org/10.1007/s10637-018-0621-x
McNamara MG, Slagter AE, Nuttall C, Frizziero M, Pihlak R, Lamarca A, et al. Sorafenib as first-line therapy in patients with advanced Child-Pugh B hepatocellular carcinoma-a meta-analysis. Eur J Cancer. 2018;105:1-9. https://doi.org/10.1016/j.ejca.2018.09.031
Iavarone M, Primignani M, Vavassori S, Sangiovanni A, La Mura V, Romeo R, et al. Determinants of esophageal varices bleeding in patients with advanced hepatocellular carcinoma treated with sorafenib. United European Gastroenterol J. 2016;4(3):363-70. https://doi.org/10.1177/2050640615615041
Dai C, Zhou F, Shao JH, Wu LQ, Yu X, Yin XB. Bleeding risk in cancer patients treated with sorafenib: A meta-analysis of randomized controlled trials. J Cancer Res Ther. 2018;14(Supplement):S948-S956. https://doi.org/10.4103/0973-1482.188430
Descargas
Publicado
Cómo citar
Número
Sección
Licencia
Derechos de autor 2022 Revista colombiana de Gastroenterología

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial-SinDerivadas 4.0.
Aquellos autores/as que tengan publicaciones con esta revista, aceptan los términos siguientes:
Los autores/as ceden sus derechos de autor y garantizarán a la revista el derecho de primera publicación de su obra, el cuál estará simultáneamente sujeto a la Licencia de reconocimiento de Creative Commons que permite a terceros compartir la obra siempre que se indique su autor y su primera publicación en esta revista.
Los contenidos están protegidos bajo una licencia de Creative Commons Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional.

| Estadísticas de artículo | |
|---|---|
| Vistas de resúmenes | |
| Vistas de PDF | |
| Descargas de PDF | |
| Vistas de HTML | |
| Otras vistas | |