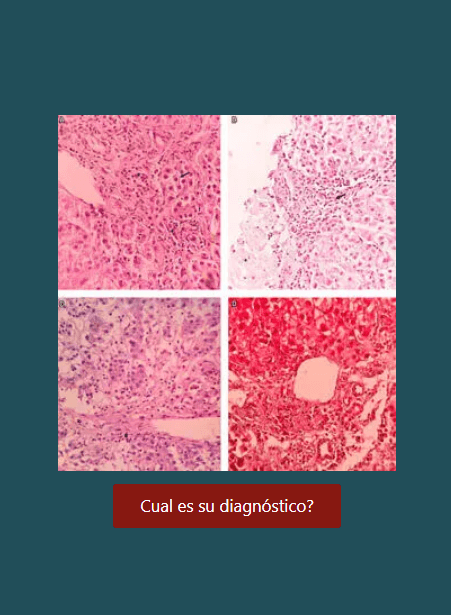
Asociación entre variables de hábitos de alimentación y la presencia de cambios tróficos gástricos en una institución de gastroenterología de Medellín, Colombia
DOI:
https://doi.org/10.22516/25007440.1024Palabras clave:
Hábitos de alimentación, Atrofia, Metaplasia, DisplasiaResumen
Objetivo: establecer la relación entre el consumo de alimentos considerados como factores de riesgo para cáncer gástrico y la presencia de cambios tróficos de la mucosa gástrica.
Materiales y métodos: estudio de corte transversal. Se incluyeron los pacientes mayores de 18 años admitidos para realización de endoscopia digestiva superior con toma de biopsias que respondieron adecuadamente una encuesta de antecedentes personales y hábitos de alimentación. Se excluyeron aquellos con antecedente de cáncer gástrico o resección quirúrgica gástrica por cualquier motivo. Se estimó la asociación entre las variables de alimentación y la presencia de cambios tróficos de la mucosa gástrica.
Resultados: en una población de 1096 pacientes, el promedio de la edad fue 51 años (desviación estándar [DE]: 15,5), y correspondió en un 59% a mujeres. Se identificaron cambios tróficos de la mucosa gástrica en 173 pacientes (15,8%). No se obtuvo asociación estadística entre las variables independientes de hábitos de alimentación, obesidad y Helicobacter pylori positivo frente a la variable “cambios tróficos”, a diferencia de la variable “antecedente familiar de cáncer gástrico” (odds ratio [OR]: 1,49; intervalo de confianza [IC] 95%: 1,03-2,17; p = 0,036). Se obtuvo 1 caso de displasia de alto grado en la población estudiada (0,91 casos en 1000 pacientes).
Conclusiones: no se estableció una asociación entre los hábitos de alimentación y la presencia de cambios tróficos de la mucosa gástrica en la población estudiada. El antecedente familiar de cáncer gástrico se muestra como un factor de riesgo estadísticamente significativo para el desarrollo de cambios de atrofia, metaplasia o displasia.
Descargas
Referencias bibliográficas
Lundberg JO, Carlström M, Weitzberg E. Metabolic Effects of Dietary Nitrate in Health and Disease. Cell Metab. 2018;28(1):9-22. https://doi.org/10.1016/j.cmet.2018.06.007
Hord NG, Tang Y, Bryan NS. Food sources of nitrates and nitrites: the physiologic context for potential health benefits. Am J Clin Nutr. 2009;90(1):1-10. https://doi.org/10.3945/ajcn.2008.27131
Song P, Wu L, Guan W. Dietary Nitrates, Nitrites, and Nitrosamines Intake and the Risk of Gastric Cancer: A Meta-Analysis. Nutrients. 2015;7(12):9872-95. https://doi.org/10.3390/nu7125505
Wroblewski LE, Peek RM. Helicobacter pylori, Cancer, and the Gastric Microbiota. En: Jansen M, Wright NA (editores). Stem Cells, Pre-neoplasia, and Early Cancer of the Upper Gastrointestinal Tract. Cham: Springer International Publishing; 2016. p. 393-408. https://doi.org/10.1007/978-3-319-41388-4_19
Oliveros Wilches R, Facundo Navia H, Bonilla Castañeda AD, Pinilla Morales RE. Factores de riesgo para cáncer gástrico: ¿cuál es su papel? Rev Colomb Gastroenterol. 2021;36(3):366-76. https://doi.org/10.22516/25007440.656
Wang F, Meng W, Wang B, Qiao L. Helicobacter pylori-induced gastric inflammation and gastric cancer. Cancer Lett. 2014;345(2):196-202. https://doi.org/10.1016/j.canlet.2013.08.016
Lahner E, Conti L, Annibale B, Corleto VD. Current Perspectives in Atrophic Gastritis. Curr Gastroenterol Rep. 2020;22(8):38. https://doi.org/10.1007/s11894-020-00775-1
Dong J, Thrift AP. Alcohol, smoking and risk of oesophago-gastric cancer. Best Pract Res Clin Gastroenterol. 2017;31(5):509-17. https://doi.org/10.1016/j.bpg.2017.09.002
Eusebi LH, Telese A, Marasco G, Bazzoli F, Zagari RM. Gastric cancer prevention strategies: A global perspective. J Gastroenterol Hepatol. 2020;35(9):1495-502. https://doi.org/10.1111/jgh.15037
Oliveros-wilches R, Grillo-Ardila CF, Vallejo-Ortega M, Gil-Parada F, Cardona-Tobón M, Páramo-Hernández D, et al. Guía de práctica clínica para la prevención primaria y secundaria y diagnóstico temprano de cáncer gástrico. Rev Colomb Cancerol. 2022;26(1):39-96. https://doi.org/10.35509/01239015.754
Yusefi AR, Bagheri Lankarani K, Bastani P, Radinmanesh M, Kavosi Z. Risk Factors for Gastric Cancer: A Systematic Review. Asian Pac J Cancer Prev. 2018;19(3):591-603. https://doi.org/10.22034/APJCP.2018.19.3.591
Li Q. Obesity and gastric cancer. Front Biosci. 2012;17(7):2383-90. https://doi.org/10.2741/4059
Thiel A, Mrena J, Ristimäki A. Cyclooxygenase-2 and Gastric Cancer. Cancer Metastasis Rev. 2011;30(3-4):387-95. https://doi.org/10.1007/s10555-011-9312-1
Lash JG, Genta RM. Adherence to the Sydney System guidelines increases the detection of Helicobacter gastritis and intestinal metaplasia in 400 738 sets of gastric biopsies. Aliment Pharmacol Ther. 2013;38(4):424-31. https://doi.org/10.1111/apt.12383
Rugge M, Meggio A, Pennelli G, Piscioli F, Giacomelli L, De Pretis G, et al. Gastritis staging in clinical practice: the OLGA staging system. Gut. 2007;56(5):631-6. https://doi.org/10.1136/gut.2006.106666
Asociación Médica Mundial. Declaración de Helsinki-Principios éticos para las investigaciones médicas en seres humanos [Internet]. Universidad de Navarra; 2013 [consultado el 4 de agosto de 2022]. Disponible en: https://rb.gy/3lqlc
Gobierno de Colombia. Resolución número 8430 de 1993, por la cual se establecen las normas científicas, técnicas y administrativas para la investigación en salud [Internet]. Ministerio de Salud de Colombia; 1993 [consultado el 4 de agosto de 2022]. Disponible en: https://rb.gy/2xg9x
Machlowska J, Baj J, Sitarz M, Maciejewski R, Sitarz R. Gastric Cancer: Epidemiology, Risk Factors, Classification, Genomic Characteristics and Treatment Strategies. Int J Mol Sci. 2020;21(11):4012. https://doi.org/10.3390/ijms21114012
Tan MC, Mallepally N, Ho Q, Liu Y, El-Serag HB, Thrift AP. Dietary Factors and Gastric Intestinal Metaplasia Risk Among US Veterans. Dig Dis Sci. 2021;66(5):1600-10. https://doi.org/10.1007/s10620-020-06399-9
Shao L, Li P, Ye J, Chen J, Han Y, Cai J, et al. Risk of gastric cancer among patients with gastric intestinal metaplasia. Int J Cancer. 2018;143(7):1671-7. https://doi.org/10.1002/ijc.31571
Corso C, Aponte DM, Preciado J, Medina-Parra J, Sabbagh Sanvicente LC. Prevalencia y localización gástrica del Helicobacter pylori en pacientes con atrofia y metaplasia intestinal en una institución de alta complejidad en Colombia. Rev Colomb Gastroenterol. 2022;37(3):289-95. https://doi.org/10.22516/25007440.858
Oliveros R, Pinilla Morales RE, Facundo Navia H, Sánchez Pedraza R. Cáncer gástrico: una enfermedad prevenible. Estrategias para intervención en la historia natural. Rev Colomb Gastroenterol. 2019;34(2):177-89. https://doi.org/10.22516/25007440.394
Liu KSH, Wong IOL, Leung WK. Helicobacter pylori associated gastric intestinal metaplasia: Treatment and surveillance. World J Gastroenterol. 2016;22(3):1311-20. https://doi.org/10.3748/wjg.v22.i3.1311
Amieva M, Peek RM. Pathobiology of Helicobacter pylori-Induced Gastric Cancer. Gastroenterology. 2016;150(1):64-78. https://doi.org/10.1053/j.gastro.2015.09.004
Luu MN, Quach DT, Hiyama T. Screening and surveillance for gastric cancer: Does family history play an important role in shaping our strategy? Asia Pac J Clin Oncol. 2022;18(4):353-62. https://doi.org/10.1111/ajco.13704
Descargas
Publicado
Cómo citar
Número
Sección
Licencia
Derechos de autor 2023 Revista colombiana de Gastroenterología

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial-SinDerivadas 4.0.
Aquellos autores/as que tengan publicaciones con esta revista, aceptan los términos siguientes:
Los autores/as ceden sus derechos de autor y garantizarán a la revista el derecho de primera publicación de su obra, el cuál estará simultáneamente sujeto a la Licencia de reconocimiento de Creative Commons que permite a terceros compartir la obra siempre que se indique su autor y su primera publicación en esta revista.
Los contenidos están protegidos bajo una licencia de Creative Commons Reconocimiento-NoComercial-SinObraDerivada 4.0 Internacional.


| Estadísticas de artículo | |
|---|---|
| Vistas de resúmenes | |
| Vistas de PDF | |
| Descargas de PDF | |
| Vistas de HTML | |
| Otras vistas | |